Résumé de cours Chimie organique 2
le PDF ci-joint contient le résumé de cours de Chimie organique 2
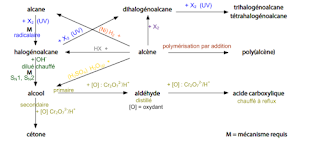
Réactions en chimie organique
Alcanes :
Les alcanes sont peu réactifs. La raison, c’est que les liaisons C-C et C-H
sont relativement fortes et qu’elles ont une faible polarité. On peut les
«brûler» et, en présence de rayons UV, ils peuvent participer à une
réaction de substitution avec un halogène.
Combustion
Les alcanes sont des hydrocarbures (formés uniquement de C et de H) et
tous les hydrocarbures brûlent très bien en présence d’une quantité
suffisante d’oxygène pour former du dioxyde de carbone et de l’eau.
L’équation générale de la combustion de tout hydrocarbure est :
Même si les liaisons C-C et C-H sont relativement fortes, les liaisons C=O
et O-H des produits le sont encore plus, ce qui fait que cette réaction est
exothermique.
Ex. : méthane (gaz naturel)
CH4(g) + 2O2(g) CO2(g) + 2H2O(l) ΔH° = -890,4 kJ mol-1
Ex. : essence (pétrole)
C8H18(l) + 121⁄2O2(g) 8CO2(g) + 9H2O(l) ΔH° = -5512 kJ mol-1
S’il y a une quantité insuffisante d’oxygène, il y a combustion incomplète
et le monoxyde de carbone (CO) ainsi que le carbone sont aussi formé
comme produit.
Réaction de substitution des alcanes :
Les alcanes peuvent réagir avec le chlore(ou autres halogènes) en
présence de rayons UV pour former du HCl et un chloroalcane.
Par exemple, le méthane peut réagir avec le chlore pour former du
chlorométhane et du chlorure d’hydrogène.
Un 2e
exemple, l’éthane peut réagir avec le brome pour former du
bromoéthane et du bromure d’hydrogène.





0 Commentaires